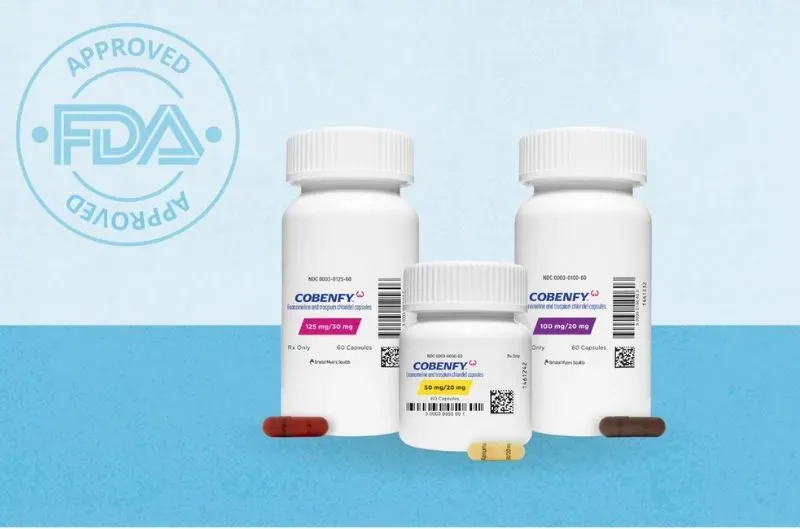
La esquizofrenia, un trastorno mental que afecta a millones de personas en todo el mundo, ha encontrado un nuevo aliado en la lucha contra sus síntomas. El pasado 26 de septiembre, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó Cobenfy, un fármaco desarrollado por Karuna Therapeutics y ahora propiedad de Bristol Myers Squibb. Este hito marca un avance significativo en el tratamiento de esta enfermedad, que a menudo deja a quienes la padecen al margen de una vida plena.
Un enfoque innovador
Cobenfy, una píldora que se administra 2 veces al día, estará disponible a finales de octubre. Este fármaco promete ofrecer una nueva opción para quienes luchan por controlar eficazmente los síntomas de la esquizofrenia.
A diferencia de los tratamientos tradicionales para la esquizofrenia, que se centran en regular la dopamina, un neurotransmisor clave en el cerebro, Cobenfy actúa sobre el sistema colinérgico. Este enfoque novedoso, que se dirige a los receptores muscarínicos, abre una nueva vía para el manejo de los síntomas de la esquizofrenia, como los delirios, las alucinaciones y los pensamientos desordenados.
Un largo camino hacia la aprobación
El desarrollo de Cobenfy es el resultado de décadas de investigación. Todo comenzó con un descubrimiento fortuito en los laboratorios de Eli Lilly, donde los científicos buscaban un tratamiento para la enfermedad de Alzheimer. Al estudiar el sistema muscarínico, se dieron cuenta de que podría ser una diana terapéutica prometedora para la esquizofrenia. Sin embargo, los efectos secundarios de los compuestos iniciales limitaron su desarrollo.
Fue Andrew Miller, cofundador de Karuna Therapeutics, quien retomó esta investigación. La revista Time explicó que su equipo exploró miles de compuestos antes de encontrar la combinación adecuada: xanomelina, un compuesto que actúa sobre los receptores muscarínicos, y un fármaco utilizado para tratar la vejiga hiperactiva. Esta combinación resultó ser eficaz para aliviar los síntomas de la esquizofrenia sin los efectos secundarios de los compuestos anteriores.
Más allá de la esquizofrenia
El potencial de Cobenfy va más allá de la esquizofrenia. Los investigadores creen que este fármaco podría ser beneficioso para otras afecciones neurológicas, como la psicosis relacionada con el Alzheimer y la manía bipolar. Actualmente, se están llevando a cabo varios ensayos clínicos para explorar estas posibilidades.
Un nuevo comienzo
La aprobación de Cobenfy representa un punto de inflexión en el tratamiento de la esquizofrenia. Aunque los tratamientos actuales han mejorado significativamente la calidad de vida de muchos pacientes, aún existe una necesidad de opciones terapéuticas más eficaces y seguras.
Los tratamientos actuales a menudo resultan insuficientes; de hecho, el 75% de los pacientes abandonan su tratamiento en un período de 18 meses debido a su ineficacia o a efectos secundarios intolerables. Solo 1,6 millones de personas que padecen esta enfermedad reciben tratamiento actual, reveló NBC News. Cobenfy ofrece una nueva esperanza para aquellos que luchan contra esta enfermedad crónica.
Efectos secundarios de Cobenfy:
- Náuseas
- Molestias gastrointestinales
- Retención urinaria
- Aumento de la frecuencia cardiaca
- Hinchazón facial (en raras ocasiones)
No se recomienda el uso del fármaco en personas con trastornos hepáticos o renales.
¿Cuáles son los próximos pasos?
A pesar de los resultados prometedores de los ensayos clínicos, aún queda mucho por aprender sobre Cobenfy. Los investigadores están interesados en estudiar la eficacia de este fármaco en combinación con otros tratamientos, así como sus efectos a largo plazo. Además, se están realizando estudios para evaluar el coste-efectividad de Cobenfy y garantizar que sea accesible para los pacientes que más lo necesitan.
Cobenfy marca el inicio de una nueva era en el tratamiento de la esquizofrenia. Este fármaco innovador ofrece una nueva esperanza para millones de personas en todo el mundo y abre la puerta a nuevas posibilidades terapéuticas para otras afecciones neurológicas.